Як у сучасній естетичній медицині вибрати безпечний препарат для контурної пластики, або «аугментації м'яких тканин», саме так у науковій медичній літературі визначається сукупність ін'єкційних методик, спрямованих на відновлення або збільшення обсягу тканин обличчя , усунення зморшок тощо?
Спеціально для читачів estet-portal.com про те, до якої категорії медичних виробів належать препарати для аугментації м'яких тканин, якими нормативними документами це регламентовано і, хто повинен стежити за безпекою та якістю даної продукції, розповів хірург, дерматолог, спеціаліст у галузі естетичної медицини Володимир Охтень.
- До якої категорії медичних виробів належать препарати для контурної пластики
- Хто контролює якість медичних виробів
- Як медичний виріб вводиться в експлуатацію
- Як на практиці лікарю визначити безпеку використовуваного препарату
- Чому всі ці пункти такі важливі для безпеки врача
До якої категорії медичних виробів належать препарати для контурної пластики
В.О.: Препарати для контурної пластики належать до медичних виробів. Для їх більш конкретної ідентифікації існує всесвітня номенклатура медичних виробів (GMDN; Global Medical Device Nomenclature), яка є список видових (дженерикових) найменувань, що використовуються для ідентифікації всієї продукції, віднесеної до медичних виробів.
>У 2019 році Міністерство економічного розвитку та торгівлі України наказом від 05.02.2019 р. № 159 затвердило національний класифікатор НКМІ 024: 2019 «Класифікатор медичних виробів», і він гармонізований з міжнародною номенклатурою , 2018.
Принципи формування особистого бренду на ринку естетичної медицини
Згідно з цією номенклатурою вироби для аугментації м'яких тканин класифіковані як Dermal tissue reconstructive material (Матеріал для корекції дефектів шкіри) і далі залежно від матеріалу (бактеріального, тваринного| id="r2">ого, людського, синтетичного походження) та наявності анестетика.
Хто контролює якість медичних виробів
В.О.: Контроль за безпекою та якістю медичних виробів у світі здійснюють певні структури, найбільш відомі такі як:
- Управління контролю якості харчових продуктів та лікарських препаратів (Food and Drug Administration, FDA, US FDA),
- Агентство з регулювання лікарських засобів та медичних виробів (Medicines and Healthcare products Regulatory Agency, MHRA United Kingdom).
У Європейському Союзі це Директива про медичне обладнання від 14.06.1993 р. 93/42/EEC (Medical Devices Directive – MD Directive, MDD), яку з 25 травня 2017 року замінює Medical Device Regulation -MDR (нині виробники схвалених медичних виробів мають перехідний період у три роки до 26 травня 2020 року).
Навчання лікарів: де отримати якісні знання
В Україні з 1 липня 2015 року стали обов'язковими до застосування Технічні регламенти у сфері медичних виробів, розроблених на основі відповідних Директив Європейського Союзу.
Зокрема та використання ін'єкційних імплантатів в Україні дозволяється у разі підтвердження їх відповідності медичному технічному регламенту, затвердженому постановою Кабінету Міністрів України №754 від 02.10.2013 року.
Згідно з цим нормативним документом, а саме додатком 2, препарати для аугментації м'яких тканин класифіковані як імплантовані медичні вироби та залежно від ступеня потенційного ризику застосування відповідно до положень Директиви 93/42/ЄС від 14 червня 1993 року "Медичні вироби" та ДСТУ 4388: 2005 "Вироби медичні. Класифікації в залежності від потенційного ризику застосування. Загальні вимоги" відносяться до III класу.
Як медичний виріб вводиться в експлуатацію
В.О.: Обов'язковою вимогою технічних регламентів щодо медичних виробів є призначення Уповноваженого представника виробника на території України, якщо виробник не є резидентом України, а це практично всі наявні на ринку препарати.
Для введення в обіг та експлуатацію медичних виробів на території України необхідно пройти процедуру оцінки відповідності щодо цих виробів та нанести національний знак відповідності.
Читайте найцікавіші статті в Telegram!

Перелік призначених органів з оцінки відповідності продукції вимогам Технічного регламенту щодо медичних виробів (зараз цих організацій 11) можна знайти на сайті Державної служби Українини з лікарських засобів та контролю за наркотиками http://dls.gov.ua.
Як на практиці лікарю визначити безпеку використовуваного препарату
В.О.: Як це виглядає на практиці, які відомості про препарат для безпечного використання лікар повинен знати та мати можливість перевірити? Ми можемо розглянути це на прикладі такого великого та відомого виробника, як Швейцарська компанія TEOXANE Laboratories.
- Виробник: ТЕОКСАН С.А., Рю де Ліон, 105, Женева, Швейцарія;
- Уповноважений представник виробника в Україні: ТОВ «Леджі груп», 01103, м.Київ, бульвар Дружби Народів, будинок18/7;
- Національний знак відповідності (затверджений постановою КМУ від 30.12.2015 р. № 1184 «Про затвердження форми, опису знака відповідності технічним регламентам, правил та умов його нанесення»):

- Код під національним знаком відповідності: UA.TR.116, є ідентифікаційним номером ТОВ ««Український науковий інститут сертифікації», який проводив оцінку відповідності продукції вимогам Технічного регламенту;
- Сертифікат: №PR/692-19, розміщений на офіційному сайті ТОВ ««Український науковий інститут сертифікації» https://uni-cert.ua/
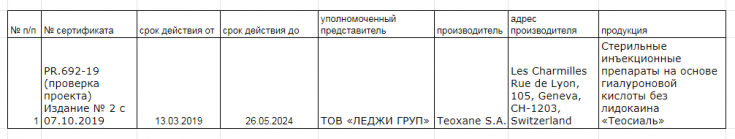
Слід зазначити, що зараз в Україні відсутній єдиний реєстр сертифікованих медичних виробів, вся інформація про сертифіковану продукцію знаходиться на офіційних сайтах кожного органу з оцінки відповідності окремо
- Зовнішня упаковка та інструкція: повинна бути українською мовою та містити інформацію, зазначену в п.1, п.2, п.3, п.4.
Отже, ми бачимо, що продукція компанії TEOXANE відповідає всім нормативним документамам для її безпечного використання.
Чому всі ці пункти такі важливі для безпеки лікаря
В.О.: На сьогоднішній день, згідно з вимогами чинного законодавства, на уповноваженого представника виробника покладено низку зобов'язань, одним з яких передбачено, що він повинен негайно інформувати виробника про скарги та повідомлення від медичних фахівців, пацієнтів про підозрілі інциденти, пов'язані з медичним виробом, адже тільки виробник може ухвалити рішення про подальші коригувальні дії або навіть відкликання продукції.
Державний ринковий нагляд та контроль здійснює «Державна служба України з лікарських засобів та контролю за наркотиками» проводячи планові та позапланові перевірки характеристик продукції.
Краса з блискучим майбутнім: секрети ідеальної шкіри
Так з 2019 року територіальні органи «Держлікслужби» здійснюють планові перевірки характеристик продукції у сфері обігу медичних виробів без письмового попередження про проведення планового заходу суб'єктів господарювання за 10 днів, на підставі Закону України «Про державний ринковий нагляд та контроль нехарчової продукції». Відповідно до ч. 1 ст. 44 Закону, суб'єкти господарювання за порушення вимог цього Закону несуть цивільну, адміністративну чи кримінальну відповідальність.
Вибираючи якісний та перевірений продукт – Ви знаходитесь у правовому полі та гарантуєте якість та безпеку контурної пластики своєму пацієнтові.
Більше корисної та цікавої інформації на нашому каналі наYouTube:








Додати коментар