На сьогоднішній день антигістамінні препарати (АГП) є одними з базових засобів лікування широкого спектру алергічних та запальних захворювань та активно використовуються лікарями у клінічній практиці. Основними показаннями до призначення АГП є алергічний ринокон'юнктивіт, різні види кропив'янки. Ці препарати також активно використовуються в дерматології для зниження інтенсивності сверблячки при дерматозах (атопічному дерматиті, свербіті, екземі), а також для усунення гострих алергічних реакцій на харчові продукти та лікарські препарати, укуси та ужалення комах.
Історія створення препаратів для боротьби з гістаміном
Історія створення цих препаратів почалася 1910 р., коли було відкрито гістамін. Гістамін – фізіологічний регулятор тканинного та метаболічного гомеостазу та одна з найбільш вивчених молекул у медицині. Основними депо гістаміну в тканинах є опасисті клітини, в крові – ndash; базофіли.
Гістамін бере участь у взаємодії між цитокінами та запальними клітинами, сприяє міграції клітин у область запалення.
Гістамін бере участь у складній бінаправленій взаємодії між цитокінами та запальними клітинами або їх попередниками, сприяє міграції клітин в область запалення, стимулює лімфоцитарну активність, регулює роботу еозинофілів, нейтрофілів і опасистих клітин і безпосередньо бере участь у генерації основних, алергічних. чхання, закладеність носа, свербіж шкіри, кропив'янка. Він є ключовим медіатором при всіх клінічних симптомах алергії, що активізує поверхневі клітинні специфічні рецептори.
Може бути цікаво Алергія на косметику і як в ній розібратися
В даний час відомо 4 типи гістамінових рецепторів
H1-рецептори експресуються на багатьох типах клітин, у т. ч. опасистих клітинах, базофілах, дендритних клітинах, ендотеліальних клітинах і клітинах гладких м'язів.
Вони відіграють важливу роль в ініціювання прозапальної активності імунних клітин при їх взаємодії з гістаміном і тим самим зумовлюють клінічні прояви алергічної реакції. Основною метою супресивної терапії H1-блокаторами є конкурентне інгібування гістамінових H1-рецепторів для запобігання розвитку ініційованих гістаміном ефектів при алергічному риніті (АР), кропив'янці та інших алергічних процесах.
У дослідженнях в останні роки було встановлено, що в нормі H1-рецептори представлені в клітинах у 2-х станах: активному та неактивному.
Гістамін зв'язується з активними рецепторами та зміщує динамічну рівновагу в їх бік. АГП стабілізують H1-рецептор в неактивному стані, будучи їх зворотним агоністом. Таким чином, АГП попереджають або зводять до мінімуму запальні реакції, які індукують гістамін.
АГП широко використовуються у клінічній практиці понад 70 років. Перші АГП були розроблені 1937 р. французькими вченими A. Staub і D. Bouvet, які працювали в інституті Пастера в Парижі (Франція). Однак у зв'язку з високою токсичністю використання цих сполук виявилося неможливим.
У 1942 р. відомим французьким ученим H. Halpern у клінічну практику було введено фенбензамін, а потім піриламін, що відносять до АГП I покоління. Згодом було розроблено та впроваджено в клінічну практику безліч препаратів цієї групи. На початку 1980-х років. було розроблено АГП нового покоління. Основна відмінність між цими двома групами препаратів полягає в наявності або відсутності у них седативного ефекту. H1-АГП I покоління (седативні) прийнято називати класичними, а H1-АГП II покоління (неседативні) – сучасними.
Як в організмі людини розвиваються алергічні реакції
До H1-АГП I покоління відносяться: дифенгідрамін, клемастин, диметинден, хлоропірамін, мебгідролін, хіфенадин, гідроксизин та ін. АГП I покоління здатні проникати через гематоенцефалічний бар'єр і, отже, зв'язуватися з H1-рецепторами в головному. >
Седативно-снодійна дія при їх прийомі відзначається у 40–80% хворих. Його відсутність в окремих пацієнтів не виключає об'єктивної негативної дії цих коштів на когнітивні функції (пам'ять, здатність до навчання, керування автомобілем).
У зв'язку з неселективністю дії та впливом на інші рецептори (М-холінорецептори, серотонінові, α-адренорецептори) та іонні канали АГП I покоління можуть викликати сухість слизових, тремтіння, синусову тахікардію, затримку сечі, запор, гіпотензивний ефект. /p>
Крім того, високі дози деяких АГП токсичні, особливо для дітей. У зв'язку з конкурентним блокуванням H1-рецепторів гістаміну терапевтичний ефект АГП І покоління швидко звернемо, що потребує застосування препаратів цієї групи кілька разів на добу.
Слід також враховувати, що ефективність препаратів у процесі лікування знижується: у 1-й тиж. застосування терапевтичний ефект є, на 2-й тиж. настає фаза звикання, але в 3-й тиж. – фаза побічної дії Отже, H1–АГП I покоління не можна застосовувати більше 14 днів.
Незважаючи на те, що Н1-АГП I покоління здатні викликати побічні ефекти, перераховані вище, вони й сьогодні широко застосовуються у клінічній практиці. У Н1-АГП I покоління є одна перевага – наявність ін'єкційних форм, незамінних при наданні екстреної допомоги, премедикації перед проведенням деяких видів діагностичного обстеження та хірургічних втручань.
В даний час накопичено великий клінічний досвід застосування АГП І покоління, але клінічних досліджень, що відповідають вимогам доказової медицини, не проводилося.
Наявність виражених побічних ефектів Н1-АГП І покоління сприяло розробці АГП ІІ покоління. Основними відмінностями Н1-АГП II покоління є висока вибірковість та специфічність дії, відсутність седативного ефекту та толерантності до препарату (тахіфілаксії).
Сучасні АГП синтезувалися протягом останніх 20 років шляхом модифікації відомих сполук. Тому за хімічною структурою вони належать до тих самих класів, що й АГП І покоління. АГП II покоління мають високу спорідненість до Н1-гістамінових рецепторів, що характеризуються швидким початком дії, тривалістю ефекту до 24 год.
Вони мають здатність до селективного впливу на Н1-рецептори, будучи антагоністами, переводять їх у неактивний стан, не порушуючи їх фізіологічних властивостей. Ці препарати не проникають через гематоенцефалічний бар'єр, тому практично не викликають сонливості.
АГП мають деякі значущі додаткові протиалергічні ефекти:
вони стабілізують мембрану опасистих клітин, зменшують експресію молекул адгезії (ICAM-1), пригнічують індуковане еозинофілами вивільнення інтерлейкіну (ІЛ) -8, гранулоцитарно-макрофагального колонієстимулюючого фактора та розчинної ICAM-1 з епітеліальних клітин.
Тому вони ефективніші, ніж АГП I покоління, під час проведення довготривалої терапії алергічних захворювань, у генезі яких значної ролі грають медіатори пізньої фази алергічного запалення. Доказова база з ефективності та безпеки АГП II покоління є досить солідною [13].
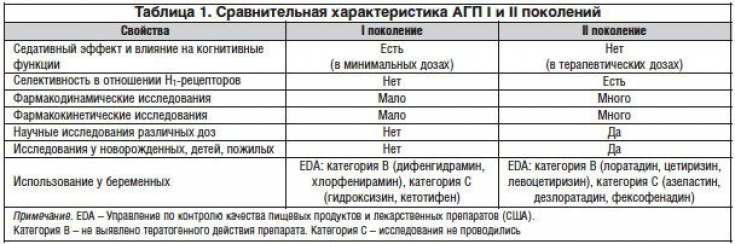
Порівняльна характеристика АГП І та ІІ поколінь представлена в таблиці 1.
АГП II покоління є неоднорідною групою насамперед через особливості їх метаболізму. Серед них виділяють дві підгрупи:
- метаболізовані препарати, які мають терапевтичний ефект тільки після трансформації в печінці під впливом ізоферменту CYP 3A4 системи цитохрому Р450 з утворенням активних сполук. До них відносяться: лоратадин, ебастин, терфенадин, астемізол;
- активні метаболіти – препарати, що надходять до організму у вигляді активної речовини (цетиризин, лівоцетиризин, дезлоратадин, фексофенадин). Мають більш сприятливий профіль безпеки, ефект цих препаратів більш передбачуваний і не залежить від активності ферментів системи цитохрому Р450, тому їх застосування є кращим.
Переваги активних метаболітів, прийом яких не супроводжується додатковим навантаженням на печінку, очевидні: швидкість та передбачуваність розвитку ефекту, можливість спільного прийому з різними лікарськими засобами та харчовими продуктами, що піддаються метаболізму за участю цитохрому P450.
Через різноманіття АГП зробити правильний вибір між тим чи іншим препаратом досить складно. Ефективність та безпека нового покоління АГП були продемонстровані під час численних рандомізованих подвійних сліпих клінічних досліджень. У клінічній практиці лікар повинен орієнтуватися на сучасні дані доказової медицини, згідно з якими H1-АГП II покоління, зокрема дезлоратадин, є препаратами першої лінії терапії широкого спектра захворювань.
Дезлоратадин є активним метаболітом – препаратом, що надходить в організм у вигляді активної речовини, що забезпечує його більш профіль безпеки.
Він був синтезований у 1998 р., у Росії зареєстрований у 2001 р. Дезлоратадин має здатність пригнічувати гостру фазу алергічної відповіді за рахунок блокування H1-рецепторів. В експериментальних дослідженнях було показано, що дезлоратадин відрізняється найбільшою спорідненістю до Н1-гістамінових рецепторів та повільною дисоціацією із зв'язку з ними.
Дезлоратадин неконкурентно зв'язується з H1-рецепторами і, за даними клінічних досліджень, має у 52, 57, 194 та 153 рази вищу активність, ніж цетиризин, ебастин, фексофенадин і лоратадин відповідно. Препарат швидко всмоктується після прийому внутрішньо і характеризується великою швидкістю досягнення максимальної плазмової концентрації та швидким початком дії (через 1,25–3 години).
Фармакокінетика дезлоратадину лінійна та пропорційна дозі. Період напіввиведення препарату становить 21–24 год, що дозволяє призначати його 1 р./добу. Прийом їжі не впливає на швидкість та ступінь всмоктування препарату. Було виявлено, що фармакокінетика та біодоступність дезлоратадину були подібними при прийомі препарату натще або після стандартизованої їжі у здорових людей (максимальна концентрація натще і після їжі склала 3,3 та 3,53 нг/мл відповідно р=0,17). Отже, препарат можна приймати як після їжі, так і натще, що свідчить про зручність його застосування. Метаболізм та виведення препарату не залежать від віку та статі хворого.
Дослідження на тваринах, in vitro та in vivo продемонстрували, що дезлоратадин, інгібуючи ряд медіаторів запалення, має додаткові антиалергічні та протизапальні ефекти, не пов'язані з блокадою Н1-гістамінових рецепторів.
У фізіологічній концентрації препарат ефективно пригнічує продукцію гістамінзалежних прозапальних цитокінів. ІЛ-6 та ІЛ-8, які, як відомо, вивільняючись з ендотеліальних клітин, базофілів і опасистих клітин, стимулюють секрецію прозапальних медіаторів, таких як фактор некрозу пухлини. Дезлоратадин впливає на активацію та виживання еозинофілів.
Еозинофіли, будучи ключовими ефекторними клітинами в алергічній реакції, продукують цитокіни, хемокіни, лейкотрієни та нейромодулятори. Крім того, дезлоратадин за рахунок зворотного агонізму знижує експресію ядерного фактора B (NF-B), відомого в якості індуктора RANTES, головного атрактанту для еозинофілів, моноцитів і Т-лімфоцитів, що сприяє активації еозинофілів і висвобо<. /p>
Дезлоратадин сильніше за інші АГП інгібує активність NF-B, що стимулює вивільнення прозапальних медіаторів з базофілів і опасистих клітин. За цим ефектом препарат перевершує цетиризин, лоратадин та фексофенадин. Останні дослідження показали, що дезлоратадин може інгібувати дегрануляцію опасистих клітин і подальше вивільнення гістаміну. Крім того, дезлоратадин пригнічує експресію Р-селектину, що індукується гістаміном.
Дезлоратадин характеризується високим рівнем безпеки при його застосуванні. Він не викликає негативних змін з боку серцево-судинної системи та інших органів, не має снодійної дії і не впливає на когнітивні функції. Препарат може застосовуватись пацієнтами з патологією гепатобіліарної системи та захворюваннями нирок, дозволений до застосування у дітей з 1 року.
У ряді представників АГП II покоління дезлоратадин виділяється більш ніж 10-річним успішним досвідом широкого медичного застосування та великою доказовою базою. Ефективність та безпека дезлоратадину в лікуванні хворих на хронічну ідіопатичну кропив'янку (ГІК) доведено численними рандомізованими плацебо-контрольованими клінічними дослідженнями (рис. 1).
J. Ring, R. Hein, A. Gauger було проведено подвійне сліпе плацебо-контрольоване багатоцентрове дослідження, що включало 190 пацієнтів із середньотяжкою та тяжкою ГІК. При загостренні захворювання 1-й групі пацієнтів призначали дезлоратадин 5 мг на добу, 2-й групі – 5 мг/добу; плацебо (контроль). Тривалість лікування досягала 6 тижнів. Первинним критерієм ефективності була середня динаміка індексу сверблячки протягом перших 7 днів лікування порівняно з вихідним показником. Було виявлено, що протягом 1-го тижня. у хворих, які отримували дезлоратадин, індекс сверблячки зменшився на 56%, а в контрольній групі – на 22% також було відзначено більш швидке регресування висипів на шкірі, ніж у контрольній групі. Було виявлено, що у пацієнтів із 1-ї групи наприкінці 1-го тижня. лікування ступінь порушення сну при застосуванні препарату зменшився на 53%, а у пацієнтів із 2-ї групи – лише на 18%. Через 6 тижнів. на фоні прийому препарату індекс сверблячки зменшився на 74%, а на фоні прийому плацебо – ndash; на 48,7%. До кінця дослідження у пацієнтів, які приймали дезлоратадин, рівень порушення сну зменшився майже на 80%. Як хворі, так і лікарі високо оцінювали загальну позитивну динаміку симптомів ХІК та відповідь на лікування дезлоратадином. Частота небажаних явищ була порівнянна у 2-х групах, серйозних небажаних реакцій не було зареєстровано [25].
так і лікарі високо оцінювали загальну позитивну динаміку симптомів ГІК та відповідь на лікування дезлоратадином. Частота небажаних явищ була порівнянна у 2-х групах, серйозних небажаних реакцій не було зареєстровано [25]. так і лікарі високо оцінювали загальну позитивну динаміку симптомів ГІК та відповідь на лікування дезлоратадином. Частота небажаних явищ була порівнянна у 2-х групах, серйозних небажаних реакцій не було зареєстровано [25].У пізнішому дослідженні 137 хворих із середньоважкою та тяжкою формами ГІК були рандомізовані на 2 групи. Пацієнтам з 1-ї групи призначали дезлоратадин 5 мг/добу, з 2-ї - плацебо протягом 6 тижнів. До кінця дослідження індекс сверблячки у групі дезлоратадину зменшився на 1,43, а у групі плацебо – ndash; на 0,86 (р = 0,004). Через 6 тижнів. кількість хворих з повною, значною або помірною відповіддю на лікування була вищою у групі хворих, які отримували дезлоратадин, порівняно з пацієнтами, які отримували плацебо (68,8 та 36,8% відповідно). Серйозних небажаних явищ зареєстровано не було, а частота будь-яких небажаних реакцій склала 11,1% у групі плацебо та 6,2% у групі дезлоратадину.
В іншому дослідженні було показано, що дезлоратадин зменшував вираженість основних клінічних симптомів ХІК, насамперед сверблячки, на 50–70%. Дія препарату тривала до 24 год. Зменшення симптомів сверблячки в кінці інтервалу прийому відзначалося у 45% (проти 4% приймали плацебо) і 69% після 6 тижнів. прийому. Також було відмічено достовірне зменшення розмірів та числа бульбашок на фоні терапії дезлоратадином при його тривалому застосуванні. Пацієнти відзначали покращення сну на 80%. Оцінка якості життя у пацієнтів з ГІК на фоні прийому препарату протягом 7 днів показала зниження балів за шкалою опитувальника Dermatology Life Quality Index (DLQI) з 13,4 до 9,1. У 60% хворих протягом зазначеного терміну індекс DLQI зменшився в середньому на 2 бали. До кінця дослідження частка таких пацієнтів досягла 77% (р<0,0001).
Ефективність та переносимість дезлоратадину у пацієнтів з алергічними захворюваннями вивчалися також у 4-х великих клінічних дослідженнях у Німеччині у 2001–2002 роках. Загальна кількість пацієнтів обох статей віком від 12 років склала 77 800. Симптоми алергічних захворювань оцінювали до і після лікування. Внаслідок лікування дезлоратадином у переважної кількості пацієнтів спостерігалося купірування симптомів, що свідчило про виражений клінічний ефект. Причому швидкий початок дії на фоні прийому дезлоратадину відзначили 67% пацієнтів та 63% лікарів. Крім усунення основних симптомів алергічних захворювань у більшості пацієнтів покращувався загальний стан у вигляді нормалізації сну та підвищення денної активності.
У клінічному дослідженні з включенням 12 050 пацієнтів було підтверджено високу терапевтичну ефективність дезлоратадину при ГІК. При цьому було зазначено, що антигістамінна та антиалергічна активність препарату не супроводжується ефектом седації та не впливає на когнітивні та психомоторні функції (концентрація уваги, пам'ять, здатність до навчання). Це дозволяє тривалий час використовувати препарат в амбулаторній практиці.
У Росії було проведено низку досліджень ефективності застосування дезлоратадину в терапії різних дерматозів, що супроводжуються суб'єктивними відчуттями у вигляді сверблячки. Ю.В. Сергєєвим та співавт. була оцінена ефективність дезлоратадину при лікуванні 26 дітей віком від 5 до 15 років, які страждають на атопічний дерматит (рис. 2). Тривалість захворювання становила від 4 до 12 років. Діти до 12 років отримували препарат у сиропі по 2,5 мг на 5 мл 2 р./добу протягом 14 днів. У дітей віком від 12 років застосовувалася таблетована форма по 5 мг на добу.
На час лікування інші лікарські засоби, у тому числі глюкокортикостероїди, були скасовані. Було показано, що через 14 днів після призначення дезлоратадину значно зменшилися свербіж, мокнення та розміри вогнищ, знизилися індекс SCORAD (у 5 і більше разів), а також рівень загального імуноглобуліну (Ig) класу E та частота виявлення IgE-антитіл до харчових та побутових алергенів. Загалом практично у 90% дітей 2-тижнева терапія дезлоратадином сприяла зменшенню сверблячки або його повному регресу. Небажаних побічних реакцій не було зазначено.
 Вивчення ефективності та безпеки дезлоратадину було проведено Н.В. Кунгуровим та співавт. у хворих на алергодерматози. Автори показали, що при атопічному дерматиті та екземі поряд з гістаміном пруритогенні ефекти підтримувалися підвищеним вмістом в організмі інших біологічно активних речовин, таких як серотонін, брадикінін, калікреїн, протеази, простагландини, лейкотрієни та ейкозаноїди. Терапія дезлоратадином по 5 мг на добу в комплексі із зовнішньою негормональною терапією дала позитивний ефект у вигляді зменшення сверблячки або його повного регресу у 90% пацієнтів. Побічних ефектів під час лікування дезлоратадином зазначено був [31].
Вивчення ефективності та безпеки дезлоратадину було проведено Н.В. Кунгуровим та співавт. у хворих на алергодерматози. Автори показали, що при атопічному дерматиті та екземі поряд з гістаміном пруритогенні ефекти підтримувалися підвищеним вмістом в організмі інших біологічно активних речовин, таких як серотонін, брадикінін, калікреїн, протеази, простагландини, лейкотрієни та ейкозаноїди. Терапія дезлоратадином по 5 мг на добу в комплексі із зовнішньою негормональною терапією дала позитивний ефект у вигляді зменшення сверблячки або його повного регресу у 90% пацієнтів. Побічних ефектів під час лікування дезлоратадином зазначено був [31].
І.М. Корсунська та співавт. оцінювали активність протисвербіжної дії дезлоратадину у хворих з фотодерматитом, сонячною екземою, кропив'янкою, екземою та атопічним дерматитом. Всім хворим з гострим перебігом процесу дезлоратадин призначався в дозі 5 мг на добу протягом 2 тижнів, при хронічній течії тривалість терапії становила 3 тижні. У всіх випадках проведене лікування було ефективним, позитивний ефект у вигляді полегшення сверблячки досягався протягом 3-7 днів терапії. У всіх хворих з фотодерматитом, сонячною екземою, кропив'янкою настало клінічне одужання після закінчення терапії, у хворих з екземою та атопічним дерматитом відзначалося значне поліпшення у вигляді відсутності сверблячки та зменшення еритеми.
Згідно з міжнародними та національними погоджувальними документами, як перша лінія медикаментозної терапії АР і полінозу рекомендується застосування неседативних АГП II покоління. Дезлоратадин задовольняє всім критеріям ARIA/EAACI і рекомендується як перша лінія лікування АР.
У нещодавно проведеному дослідженні в Інституті імунології вивчалися ефективність та безпека (переносимість) дезлоратадину у пацієнтів із сезонним АР. У дослідження було включено 30 пацієнтів (12 чоловіків та 18 жінок) з АР у період загострення, які протягом 28 днів отримували дезлоратадин по 5 мг на добу. Пацієнти щодня оцінювали динаміку симптомів АР, а також потребу в топічних деконгестантах до початку курсу лікування та в період терапії. Усі 30 пацієнтів, які отримували препарат, відзначили зменшення вираженості симптомів АР (виділень з носа, стікання слизу по задній стінці глотки, чхання та закладеності носа), а також очних симптомів (сверблячка в очах, сльозотечі та почервоніння очей).
Поліпшення стану відзначалося вже до кінця 1-го тижня. прийому, і ця тенденція зберігалася протягом 4 тижнів. спостереження. До кінця курсу лікування повна ремісія та значне покращення відзначили 73% хворих. Дослідження показали, що дезлоратадин є високоефективним препаратом щодо зменшення виразності назальних та очних симптомів у пацієнтів із сезонним АР та кон'юнктивітом.
Він має хороший профіль безпеки, призводить до поліпшення якості життя пацієнта і може бути рекомендований як монотерапія у хворих на АР з легким перебігом захворювання і в комплексній терапії у хворих на АР із середньотяжким та тяжким перебігом.
При АР до складу комплексної терапії часто включаються назальні деконгестанти для місцевого застосування у вигляді крапель або спрею та аерозолю. Одним із активно використовуваних засобів у клінічній практиці є препарат Евказолін. Основний компонент препарату – ndash; ксилометазолін, має судинозвужувальну та протинабрякову дію, внаслідок чого відновлюється носове дихання. За рахунок евкаліптової олії, що входить до складу препарат має протизапальну та антимікробну дію.
Препарат має -адреноміметичну дію, зменшує гіперемію, ексудацію, полегшує носове дихання. Завдяки евкаліптовій олії, що входить до його складу, препарат усуває сухість слизової оболонки порожнини носа і має протизапальну та антисептичну дію.
Діє переважно місцево, при використанні в терапевтичних дозах всмоктується через слизові оболонки у незначній кількості. Дія починається через кілька хвилин після застосування, триває протягом 8-10 год. Показання до застосування препарату: гострий риніт і риносинусит, поліноз; середній отит (для зменшення набряку слизової оболонки носоглотки); а також підготовка пацієнта до діагностичних та лікувальних процедур у носових ходах.
У Росії Евказолін випускається у формі Евказолін Аква спрею. Препарат призначають дорослим і дітям віком старше 12 років по 1 впорскування 2-3 р./добу в кожний носовий хід. Тривалість застосування препарату – ndash; 5–7 днів.
Таким чином, дезлоратадин може застосовуватися при гострих та хронічних захворюваннях шкіри як у формі монотерапії, так і у складі комплексної терапії. Дезлоратадин має найбільшу афінність до H1-рецептора, повільно дисоціює, має властивості як нейтрального антагоніста, так і зворотного агоніста і відрізняється найтривалішим періодом напіврозпаду в порівнянні з іншими представниками H1-АГП II покоління. Він не має седативного ефекту і не викликає інших побічних реакцій, пов'язаних із впливом на ЦНС. Препарат ефективний у лікуванні АР, дерматозів, що сверблять, зокрема таких, як атопічний дерматит, алергічний контактний дерматит, екзема, кропив'янка, червоний плоский лишай, мастоцитоз, а також при ідіопатичному свербіні.
Прихильність пацієнта до певного виду терапії та конкретного препарату залежить від ефективності, рівня безпеки, зручності застосування та вартості препарату. Оскільки більшість алергічних захворювань мають хронічний характер, і пацієнт оплачує лікування зі своїх власних засобів, економічна доступність лікарського засобу має велике значення.
Тож крім оригінального препарату, дезлоратадин на фармацевтичному ринку представлений рядом дженериків, вартість яких нижча. Збільшення асортименту високоефективних та безпечних протиалергічних засобів, одним з яких є препарат Елізей (дезлоратадин 5 мг), розширює вибір хворим на ліки за фармакоекономічними критеріями, підвищуючи доступність якісного лікування для великої кількості пацієнтів з алергічними захворюваннями.
Елізей – блокатор гістамінових Н1-рецепторів (тривалої дії) є первинним активним метаболітом лоратадину. Інгібує вивільнення гістаміну та лейкотрієну С4 з опасистих клітин. Запобігає розвитку та полегшує перебіг алергічних реакцій.
Має протиалергічну, протисвербіжну та протиексудативну дію. Зменшує проникність капілярів, запобігає розвитку набряку тканин, знімає спазм гладкої мускулатури. Практично не має седативного ефекту і при прийомі в дозі 7,5 мг не впливає на швидкість психомоторних реакцій. У порівняльних дослідженнях дезлоратадину та лоратадину якісних чи кількісних відмінностей токсичності 2-х препаратів у порівнянних дозах (з урахуванням концентрації дезлоратадину) не виявлено.
Елізей застосовується для усунення симптомів, пов'язаних з такими станами: АР (чхання, виділення з носа, свербіж та закладеність носа, свербіж та почервоніння очей, сльозотеча, свербіж у ділянці неба); кропив'янка (свербіж, висип). Препарат застосовують внутрішньо в один і той же час доби.
Дорослим та дітям з 12 років препарат призначається в дозі 5 мг (1 таблетка) 1 р./добу, незалежно від прийому їжі. Тривалість лікування залежить від тяжкості та перебігу захворювання. Лікування інтермітуючого АР (наявність симптомів менше 4 днів на 1 тиж. або менше 4 тиж.) необхідно проводити з урахуванням анамнестичних та клінічних даних: припинити після зникнення симптомів та відновити після повторного їх виникнення. При персистуючому АР (наявність симптомів більше 4 днів на 1 тиж. або більше 4 тиж.) необхідно продовжувати лікування протягом усього періоду контакту з алергеном.Таким чином, застосування АГП ефективно усуває симптоми алергічних реакцій, покращуючи якість життя пацієнтів.
Алергени восени: основні причини виникнення недуги










Додати коментар