Про ботулінотерапію постінсультного спастичного парезу розповідає лікар-невролог Андрій Корольов.
Спастичний парез
Спастичний парез, що розвинувся після мозкового інсульту, зазвичай зберігається протягом усього життя хворого. При цьому розвиваються вторинні зміни у м'язах, сухожиллях та суглобах. У зв'язку з цим актуальна розробка підходів до лікувального впливу на м'язову спастичність, у тому числі з використанням ін'єкцій ботулотоксину.

Андрій Анатолійович Корольов, лікар-невролог, кандидат медичних наук, член асоціації неврологів Санкт-Петербурга, Міжрегіональної громадської організації фахівців ботулінотерапії
Спастичний м'язовий гіпертонус характеризується виникненням опору, що збільшується, при перших швидких пасивних рухах і потім раптовому зменшенні його — феномен “складного ножа” за Шеррінгтоном. В даний час під спастичність розуміють рухове порушення, що є частиною синдрому ураження верхнього мотонейрону, що характеризується швидкість-залежним підвищенням м'язового тонусу і супроводжується підвищенням сухожильних рефлексів внаслідок гіперзбудливості рецепторів розтягування.
Одного разу, спастичний парез, як правило, зберігається протягом усього життя хворого. При цьому якщо спастичність зберігається протягом тривалого часу, розвиваються вторинні зміни у м'язах, сухожиллях та суглобах (фіброз, атрофія, контрактура). Лікування спастичного парезу - поки що практично нерозв'язне завдання. У зв'язку з цим настільки актуальною є розробка підходів до лікувального впливу на м'язову спастичність, що ґрунтуються на вивченні механізмів її розвитку.
Для корекції м'язового гіпертонусу нерідко використовують різні методи фізіотерапії, лікувальної фізкультури, рефлексотерапії, а також фармакологічне лікування як призначення міорелаксантів.
Препарати ботулінічного нейротоксину типу А як дієвий метод лікування постінсультної статичності.
В останні роки при лікуванні постінсультної спастичності стали застосовуватися препарати ботулінічного нейротоксину типу А. Даний метод лікування запропонований для освоєння практикуючим лікарям порівняно недавно, незважаючи на те, що перше наукове повідомлення про застосування блокад ботулотоксину з'явилося у пресі понад 20 років тому. /p>
У порівнянні з наявними методами лікування м'язового гіпертонусу, локальне введення ботулотоксину має низку безперечних переваг. По-перше, лікування добре переноситься і не пов'язане із ризиком серйозних ускладнень. По-друге, можливий вибір одного або декількох м'язів для ін'єкції та добір дози препарату, що забезпечує бажаний ступінь розслаблення.
Механізм дії ботулотоксину
Як відомо, ботулізм — тяжке інфекційне захворювання, що проявляється периферичними паралічами м'язів та вегетативними розладами внаслідок порушення периферичної холінергічної медіації, що викликається ботулінічним нейротоксином. В даний час відомі 8 серологічних підтипів ботулотоксину: А, В, С1, С2, D, E, F, G. Ботулізм у людини можуть викликати серотипи А, В, Е, F, G, але найсильнішим є тип А. >
Як у своїй природній формі, так і у вигляді ліків ботулотоксин є сумішшю різних білків. Основні складові їх частини - нейротоксин та нетоксичні протеїни. Нейротоксин складається з двох поліпептидних ланцюгів (легким масою 50 кДа і важким масою 100 кДа), з'єднаних однією дисульфідною групою і одним атомом цинку. Така структура молекули нейротоксину обумовлює лабільність її конформації та нестійкість до дії механічних, фізичних та хімічних факторів, що призводять до втрати біологічної активності. У своїй лікарській формі нейротоксинові ланцюги оточені та стабілізовані великими пептидними молекулами гемагглютинінів та нетоксичних негемагглютинінових протеїнів. Велика молекулярна маса нетоксичної частини комплексу (730 кДа) перешкоджає розщепленню нейротоксину, і швидкої дифузії їх у навколишні тканини, забезпечуючи цим локальність впливу. Однак присутність білкових молекул є фактором, що сприяє утворенню нейтралізуючих антитіл до всього нейротоксин-гемагглютинінового комплексу, що може спричинити вторинну нечутливість пацієнтів до повторних ін'єкцій препарату.
Амінокислотний склад нейротоксину типу А розшифрований, у легкому ланцюзі міститься 448 амінокислот, у тяжкому — 848. Інші серотипи ботулотоксину відрізняються кількістю та послідовністю амінокислот, головним чином, у легкому ланцюзі.
Принциповий механізм дії всіх типів ботулінічних токсинів полягає у пресинаптичній блокаді викиду ацетилхоліну з нервової терміналі периферичного холінергічного синапсу.
Передача нервового імпульсу в холінергічному синапсі відбувається в кілька етапів. У пресинаптичній нервовій терміналі постійно синтезується і накопичується ацетилхолін у вигляді везикул, які транспортуються до пресинаптичної мембрани, щоб молекула медіатора могла вийти в синаптичну щілину і зв'язатися зі специфічними холінергічними рецепторами постсинаптичної мембрани. На цій ділянці постсинаптичної мембрани виникає мембранний потенціал та відбувається скорочення м'язового волокна. Однак процес транспорту везикул ацетилхоліну до пресинаптичної мембрани відбувається не спонтанно, а активно за допомогою комплексу особливих транспортних білків, головними з яких є SNAP-25, синтаксин та синаптобревін. Саме транспортні білки є мішенню дії ботулінічних нейротоксинів. При попаданні ботулотоксину в м'яз або інший орган-мішень (зі струмом крові при ботулізмі або з лікувальною метою при ін'єкції) молекули токсинового комплексу досягають нервових терміналей аксонів, прикріплюються до них, і далі нейротоксинова частина впроваджується в цитозоль нервової терміналі, де розпадається на довгий ланцюг. Короткий ланцюг (що є цинк-залежною протеазою) незворотно і специфічно розщеплює транспортний білок, тим самим унеможливлюючи вихід ацетилхоліну в синаптичну щілину та м'язове скорочення.
Ефекти ін'єкції ботулотоксину та способи їх продовження
При внутрішньом'язовому введенні ботулотоксину розвиваються два ефекти: пряме інгібування альфа-мотонейронів на рівні нервово-м'язового синапсу та інгібування гамма-мотонейронного холінергічного синапсу на інтрафузальному волокні. Зниження гамма-активності веде до розслаблення інтрафузальних волокон м'язового веретена та зменшує активність 1а-аферентів. Це призводить до зниження активності як м'язових рецепторів розтягування, так і еферентної активності альфа- та гамма-мотонейронів. Клінічно це проявляється у вираженому розслабленні ін'єктованих м'язів та значному зменшенні болю в них.
При локальному введенні в терапевтичних дозах ботулотоксин не проникає через гематоенцефалічний бар'єр і не викликає суттєвих системних ефектів. Процес пресинаптичного розщеплення транспортних білків ботулотоксином є незворотним і займає в середньому 30-60 хвилин, тому специфічний ботулінічний антитоксин ефективний лише протягом півгодини після надходження токсину до органів-мішеней. Незважаючи на те, що клітинні ефекти розвиваються дуже швидко і необоротно, клінічна міорелаксуюча дія препарату після ін'єкції починає проявлятися через кілька днів. Однак є спостереження як миттєвого ефекту, так і відстроченого на 3–4 тижні.
Через 1–2 місяці після ін'єкції починається процес відростання нових нервових терміналей від аксонів, де раніше був блокований транспорт ацетилхоліну, з утворенням нових функціонально активних нервово-м'язових синапсів (спраутинг), що призводить до відновлення м'язових скорочень через 3 –6 місяців після ін'єкції, але іноді тривалість ефекту зберігається до 1 року та більше.
Гістологічними дослідженнями доведено, що навіть після 30 повторних ін'єкцій в один і той же м'яз не виникає незворотної деіннервації та атрофій.
Винятково важливою є розробка способів посилення та продовження ефекту ін'єкції, оскільки часті повторні ін'єкції можуть призводити до утворення антитіл, а також суттєво здорожчають вартість лікування. Виявлено, що більш стійкі та повні ефекти токсину виявляються при максимальному м'язовому скороченні, достатньої внутрішньоклітинної концентрації іонів кальцію (можливо і калію), при впливі низьких температур. Тому під час підготовки до лікувальної ін'єкції за 2 тижні пацієнту рекомендується призначити прийом препаратів кальцію та калію з вітаміном D, безпосередньо перед ін'єкцією та одразу після неї – охолоджувати область ін'єкції, а також інтенсивно напружувати м'язи, що ін'єкуються, протягом 15–30 хвилин після процедури. /p>
Розмір поля деіннервації, що викликається ін'єкцією токсину, залежить від дози токсину та об'єму розчину, що вводиться. Найкращі результати досягаються при рівномірному розподілі препарату на кілька точок уздовж одного м'яза. Крім того, повніша блокада нервових терміналів настає при ін'єкції токсину поблизу кінцевих моторних пластинок периферичного нерва.
В даний час накопичилися факти, що свідчать про те, що ефекти ботулотоксину значно складніші та ширші, ніж тимчасовий локальний блок проведення в терміналях альфа-мотонейронів. Очевидно, є блокада як інтрафузальних, і екстрафузальних волокон, що може пояснити ширшу зону дії токсину і терміналі чутливих волокон різної модальності. Зокрема це може пояснити швидкий аналгетичний ефект ін'єкції ботулотоксину. За рахунок механізму деаферентації рецепторів м'язових веретен та інших видів чутливих систем ботулотоксин може чинити непрямі ефекти на відділи центральної нервової системи, що лежать вище. При дослідженні моторного потенціалу виявлено зменшення латентних періодів його компонентів,
Методика призначення препаратів ботулотоксину
Слід уникати призначення більш ніж 300–400 ОД протягом однієї сесії ін'єкції. До теперішнього часу не виявлено серйозних побічних дій препаратів ботулотоксину при застосуванні його у дозах, що рекомендуються. Можливе виникнення надмірної м'язової слабкості, проте згодом відбувається відновлення м'язової сили. Може також спостерігатися вторинна резистентність до препарату, для профілактики якої рекомендують робити інтервал між сесіями ін'єкцій не менше 12 тижнів. Не виявлено також ефекту взаємодії ботулотоксину та пероральних міорелаксантів центральної дії.
На сьогоднішній день широке застосування ботулінотерапії при постінсультній спастичності значною мірою обмежується високою вартістю препарату. Однак проведене в Німеччині дослідження з вивчення ефективності трьох варіантів лікування постінсультної спастичності: фізіотерапія, ботулінотерапія + фізіотерапія, баклофен + фізіотерапія - показало, що зниження спастичності при поєднанні ботулотоксину і фізіотерапії було втричі значніше, ніж при використанні бафену разів більше, ніж при застосуванні однієї фізіотерапії. Оцінка показника вартість/ефективність лікування постінсультної спастичності була нижчою при використанні ботулотоксину та фізіотерапії, ніж при інших методах лікування.
Для більш обґрунтованого призначення препарату O'Brien С. (Muscle and Nerve, 1997) рекомендує дотримуватись наступного алгоритму призначення препаратів ботулотоксину при постінсультній спастичності (мал. нижче).
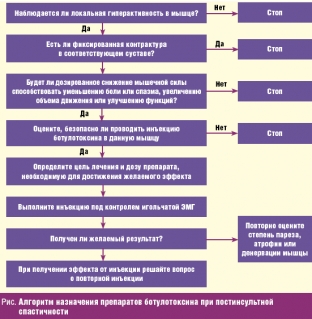
У цьому алгоритмі С. O'Brien не рекомендує проведення ботулінотерапії при фіксованих контрактурах у суглобах. У ситуації фіксованої контрактури, викликаної укороченням сухожиль або дистрофічними змінами в самому суглобі, введення ботулотоксину призводить до розслаблення спастичних м'язів, але обсяг руху в суглобі не збільшується і рухові функції залишаються незмінними. Однак, на думку Е. Д. Білоусової (Неврологічний журнал, 2001), зважаючи на наявність функціонально невигідної контрактури (кисті, еквіноварусної деформації стопи), що не забезпечує працездатність кінцівки, вираженого больового синдрому, введення ботулінічного токсину в спастичні м'язи є обґрунтованим. >
В даний час розрахунок дози препарату ботулотоксину типу А, а також точки його введення у м'язи-мішені при різних проявах постінсультної спастичності визначають за рекомендаціями Brin MF та Spasticity Study Group (табл. нижче).
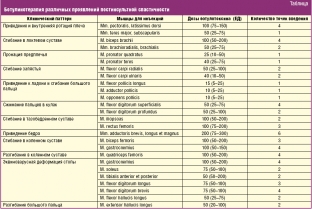
За даними рекомендаціями, мінімальні дози нейротоксину вводять за легкого ступеня спастичності, максимальні дози — за вираженого ступеня спастичності та великих розмірів м'язів. Загальна доза препарату не повинна перевищувати 400 ОД.
У всіх пацієнтів з постінсультними спастичними руховими розладами, у зв'язку з підвищенням тонусу згиначів зап'ястя і пальців рекомендується обов'язкове введення ботулотоксину в наступні м'язи: променевий згинач зап'ястя по 20–40 ОД, ліктьовий згинач зап'ясток0Д, 20 по 20-40 ОД, глибокий згинач пальців по 30-60 ОД. Загальна доза препарату становить 75-150 ОД. Ін'єкції всіх цих м'язів (в 1-2 точки) здійснюються при введенні ін'єкційної голки в поперечному по відношенню до передпліччя напрямку з поетапним введенням препарату в кожен м'яз. В інші м'язи-мішені верхньої кінцівки введення ботулотоксину залежить від клінічного патерну.
У нижній кінцівці, у зв'язку з підвищенням м'язового тонусу в задній групі м'язів гомілки, з'ясовується, який з м'язів задньої групи гомілки (литковий або камбаловидний) відіграє провідну роль у спастичності. Якщо високий тонус у гомілковостопному суглобі (при тильному згинанні стопи) визначається при розігнутому колінному суглобі, але суттєво слабшає при згинанні, то це вказує на провідну роль литкового м'яза в спастичності, оскільки при згинанні коліна відбувається розслаблення литкового м'яза, що бере участь як так і в підошовному згинанні гомілковостопного суглоба. У цих випадках вводять 100-150 ОД ботулотоксину в чотири точки литкового м'яза (по 25-35 ОД у кожну точку). У тих випадках, коли спастичність однаковою мірою викликана як литковою, так і камбаловидною, додатково, в дозі 50-100 ОД у дві точки (по 25-50 ОД), препарат вводять у камбаловидний м'яз. Вибір інших м'язів-мішеней ноги також залежить від клінічного патерну [34].
Максимальний ефект після проведення ботулінотерапії відзначається в середньому через 2–3 тижні після ін'єкцій. Повторне наростання м'язової спастичності відбувається зазвичай через 4–6 місяців після введення ботулотоксину, що потребує повторення процедури.
На закінчення слід зазначити, що у всіх випадках після проведення ботулінотерапії потрібна активна фізіотерапія та фізична реабілітація. Ботулінотерапія не замінює фізіотерапію та лікувальну фізкультуру, що становить основу реабілітаційної програми у хворих, які перенесли мозковий інсульт, а є лише інтегральною частиною комплексного відновного лікування, спрямованого на покращення рухових функцій.
Значна кількість питань, пов'язаних із застосуванням ботулінічного токсину при спастичності, вимагають подальшого вивчення. По-перше, чи безпечне та ефективне використання великих доз ботулотоксину, що часто необхідно при вираженій спастичності у багатьох м'язах у хворих після мозкового інсульту? По-друге, у які терміни з моменту інсульту слід проводити ботулінотерапію? По-третє, які оптимальні дози та точки введення препарату у різні м'язи? По-четверте, яка комбінація засобів медичної реабілітації та ботулінотерапії оптимальна у різних термінах давності захворювання?Таким чином, проблема відновного лікування постінсультного спастичного м'язового гіпертонусу з використанням ботулотоксину протягом багатьох років займає одне з важливих місць у практичній неврології та нейрореабілітації та потребує подальшого вивчення.
За матеріалами lvrach.ru







Додати коментар